- ავტორი Jason Gerald [email protected].
- Public 2024-02-01 14:14.
- ბოლოს შეცვლილი 2025-06-01 06:06.
ოდესმე დაგიტოვებიათ წყლის ბოთლი ცხელ მზეზე რამდენიმე საათით და გახსნისას გსმენიათ უმნიშვნელო "ჩურჩულის" ხმა? ეს გამოწვეულია პრინციპით, რომელსაც ეწოდება ორთქლის წნევა. ქიმიაში ორთქლის წნევა არის წნევა, რომელსაც ახორციელებს დახურული კონტეინერის კედლები, როდესაც მასში ქიმიური ნივთიერება აორთქლდება (გადადის გაზში). მოცემულ ტემპერატურაზე ორთქლის წნევის საპოვნელად გამოიყენეთ კლაუსიუს-კლაპეირონის განტოლება: ln (P1/P2) = (ΔHორთქლი/რ) ((1/T2) - (1/T1)).
ნაბიჯი
3 მეთოდი 1: კლაუსიუს-კლაპეირონის განტოლების გამოყენება
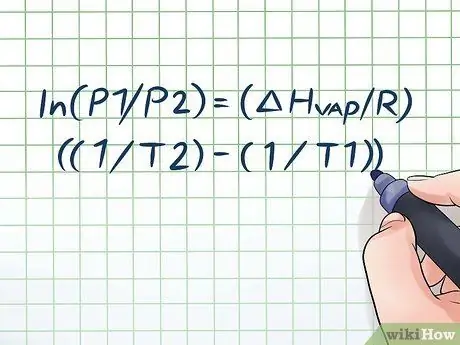
ნაბიჯი 1. ჩაწერეთ კლაუსიუს-კლაპეირონის განტოლება
დროთა განმავლობაში ორთქლის წნევის ცვლილებით ორთქლის წნევის გამოსათვლელად ეწოდება კლაუსიუს - კლაპეირონის განტოლება (ფიზიკოსების რუდოლფ კლაუსიუსისა და ბენოიტ პოლ მილა კლაპეირონის სახელის მიხედვით). ორთქლის წნევის შესახებ კითხვები ხშირად გვხვდება ფიზიკისა და ქიმიის კლასებში. ფორმულა ასეთია: ln (P1/P2) = (ΔHორთქლი/რ) ((1/T2) - (1/T1)) რა ამ ფორმულაში ცვლადები წარმოადგენენ:
-
თორთქლი:
სითხის აორთქლების ენთალპია. ეს ენთალპია ჩვეულებრივ შეგიძლიათ ნახოთ ქიმიის სახელმძღვანელოს უკანა ცხრილში.
-
რ:
რეალური/უნივერსალური გაზის მუდმივი, ან 8.314 J/(K × Mol).
-
Q1:
ტემპერატურა, რომლის დროსაც ცნობილია ორთქლის წნევა (ან საწყისი ტემპერატურა).
-
T2:
ტემპერატურა, რომლის დროსაც ორთქლის წნევა უცნობია/სურდა მისი პოვნა (ან საბოლოო ტემპერატურა).
-
P1 და P2:
ორთქლის წნევა შესაბამისად T1 და T2 ტემპერატურაზე.

ნაბიჯი 2. შეიყვანეთ თქვენთვის ცნობილი ცვლადები
კლაუსიუს-კლაპეირონის განტოლება რთულად გამოიყურება, რადგან მას აქვს ბევრი განსხვავებული ცვლადი, მაგრამ ეს არ არის ისეთი რთული, თუ თქვენ გაქვთ სწორი ინფორმაცია. ორთქლის წნევის ძირითადი პრობლემები ჩამოთვლის ტემპერატურის ორ მნიშვნელობას და წნევის ერთ მნიშვნელობას ან წნევის ორ მნიშვნელობას და ტემპერატურის მნიშვნელობას - მას შემდეგ რაც გაარკვევთ, ამ განტოლების ამოხსნა ძალიან ადვილია.
- მაგალითად, თქვით, რომ ჩვენ გვეუბნებიან, რომ ჩვენ გვაქვს 295 K ტემპერატურაზე სავსე კონტეინერი, რომლის ორთქლის წნევაა 1 ატმოსფერო (ატმ). ჩვენი კითხვაა: რა არის ორთქლის წნევა 393 K- ზე? ჩვენ გვაქვს ორი ტემპერატურის მნიშვნელობა და ერთი წნევის მნიშვნელობა, ასე რომ ჩვენ შეგვიძლია ვიპოვოთ სხვა წნევის მნიშვნელობები კლაუსიუს-კლაპეირონის განტოლების გამოყენებით. ჩვენი ცვლადების ჩართვით, ჩვენ ვიღებთ ln (1/P2) = (ΔHორთქლი/რ) ((1/393) - (1/295)).
- გაითვალისწინეთ, რომ კლაუსიუს-კლაპეირონის განტოლებისთვის თქვენ ყოველთვის უნდა გამოიყენოთ ტემპერატურის მნიშვნელობა კელვინი რა თქვენ შეგიძლიათ გამოიყენოთ ნებისმიერი წნევის მნიშვნელობა, სანამ P1 და P2 მნიშვნელობები იგივეა.

ნაბიჯი 3. შეიყვანეთ თქვენი მუდმივები
კლაუსიუს-კლაპეირონის განტოლებას აქვს ორი მუდმივი: R და Hორთქლირა R ყოველთვის უდრის 8.314 J/(K × მოლს). თუმცა, ჰორთქლი (აორთქლების ენთალპია) დამოკიდებულია ნივთიერებაზე, რომლის ორთქლის წნევასაც თქვენ ეძებთ. როგორც ზემოთ აღინიშნა, თქვენ ჩვეულებრივ შეგიძლიათ იპოვოთ H მნიშვნელობებიორთქლი ქიმიური ან ფიზიკის სახელმძღვანელოს უკან, სხვადასხვა ნივთიერებებისათვის, ან ონლაინ რეჟიმში (მაგალითად, აქ.)
-
ჩვენს მაგალითში დავუშვათ, რომ ჩვენი სითხე არის სუფთა წყალი.
თუ ცხრილში შევხედავთ H მნიშვნელობებსორთქლი, ჩვენ ვხვდებით, რომ ჰორთქლი სუფთა წყალი არის დაახლოებით 40,65 კჯ/მოლი. ვინაიდან ჩვენი H მნიშვნელობა არის ჯოულებში და არა კილოჯოულებში, ჩვენ შეგვიძლია მისი გარდაქმნა 40,650 J/mol.
- ჩვენი მუდმივების ჩართვით, ჩვენ ვიღებთ ln (1/P2) = (40,650/8, 314) ((1/393) - (1/295)).
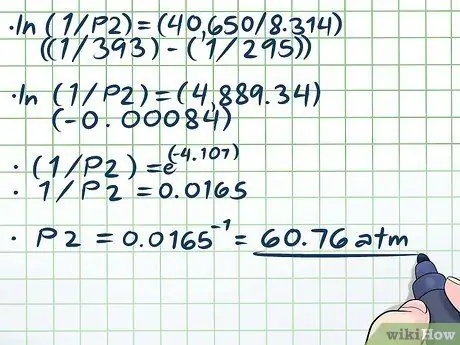
ნაბიჯი 4. განტოლების ამოხსნა
მას შემდეგ რაც განტოლებაში შეიტანეთ ყველა ცვლადი გარდა იმისა, რასაც ეძებდით, განაგრძეთ განტოლების ამოხსნა ჩვეულებრივი ალგებრის წესების მიხედვით.
-
ჩვენი განტოლების ამოხსნის ერთადერთი რთული ნაწილი (ln (1/P2) = (40,650/8, 314) ((1/393) - (1/295))) წყვეტს ბუნებრივ ჟურნალს (ln). ბუნებრივი ჟურნალის ამოსაღებად, უბრალოდ გამოიყენეთ განტოლების ორივე მხარე, როგორც მათემატიკური მუდმივობის გამომხატველი e. Სხვა სიტყვებით, ln (x) = 2 → ეln (x) = ე2 → x = ე2.
- ახლა მოდით განვსაზღვროთ ჩვენი განტოლება:
- ln (1/P2) = (40,650/8, 314) ((1/393) - (1/295))
- ln (1/P2) = (4889, 34) (-0, 00084)
- (1/P2) = ე(-4, 107)
- 1/P2 = 0.0165
-
P2 = 0.0165-1 = 60, 76 ატმოსფერო
ეს აზრი აქვს - დახურულ კონტეინერში, ტემპერატურის აწევა თითქმის 100 გრადუსამდე (დუღილის წერტილიდან თითქმის 20 გრადუსამდე) გამოიმუშავებს უამრავ ორთქლს, სწრაფად გაზრდის წნევას.
3 მეთოდი 2: ორთქლის წნევის პოვნა გახსნილი ხსნარით
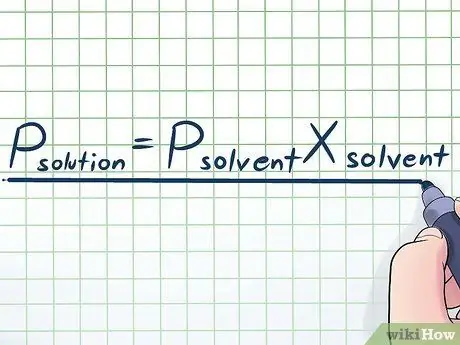
ნაბიჯი 1. ჩაწერეთ რაულტის კანონი
რეალურ ცხოვრებაში, ჩვენ იშვიათად ვმუშაობთ სუფთა სითხესთან - ჩვეულებრივ, ჩვენ ვმუშაობთ თხევადთან, რომელიც რამდენიმე სხვადასხვა ნივთიერების ნარევია. ზოგიერთი ყველაზე ხშირად გამოყენებული ნარევი მზადდება მცირე რაოდენობით გარკვეული ქიმიკატის ხსნარით, რომელსაც ხსნარი ჰქვია ხსნარში, ხსნარის გასაკეთებლად. ამ შემთხვევებში სასარგებლოა იცოდეთ განტოლება სახელწოდებით რაულტის კანონი (ფიზიკოსის ფრანსუა-მარი რაულტის სახელობის), რომელიც ასეა დაწერილი: პგამხსნელი= პგამხსნელიXგამხსნელი რა ამ ფორმულაში ცვლადები წარმოადგენენ;
-
პგამხსნელი:
მთლიანი ხსნარის ორთქლის წნევა (ყველა ელემენტი კომბინირებული)
-
პგამხსნელი:
გამხსნელი ორთქლის წნევა
-
Xგამხსნელი:
გამხსნელის მოლური ნაწილი
- არ ინერვიულოთ, თუ თქვენ არ იცით ტერმინები, როგორიცაა mole ფრაქცია - ჩვენ ავუხსნით მათ მომდევნო რამდენიმე ნაბიჯში.

ნაბიჯი 2. განსაზღვრეთ გამხსნელი და ხსნარი თქვენს ხსნარში
სანამ გამოთვლით შერეული სითხის ორთქლის წნევას, თქვენ უნდა დაადგინოთ ის ნივთიერებები, რომლებსაც იყენებთ. შეგახსენებთ, რომ ხსნარი წარმოიქმნება, როდესაც ხსნარი იხსნება გამხსნელში - ქიმიკატს, რომელიც იხსნება, ყოველთვის უწოდებენ გამხსნელს, ხოლო ქიმიურ ნივთიერებას, რომელიც მას ხსნის, ყოველთვის გამხსნელს უწოდებენ.
- მოდით ვიმუშაოთ ამ სექციის მარტივი მაგალითების გამოყენებით, რათა განვსაზღვროთ ჩვენს მიერ განხილული ცნებები. ჩვენი მაგალითისთვის, ვთქვათ, ჩვენ გვინდა ვიპოვოთ შაქრის სიროფის ორთქლის წნევა. ტრადიციულად, შაქრის სიროფი არის წყალში ხსნადი შაქარი (1: 1 თანაფარდობა), ამიტომ შეგვიძლია ვთქვათ შაქარი არის ჩვენი გამხსნელი და წყალი არის ჩვენი გამხსნელი.
- გაითვალისწინეთ, რომ საქაროზის (სუფრის შაქარი) ქიმიური ფორმულა არის C12თ22ო11რა ეს ქიმიური ფორმულა იქნება ძალიან მნიშვნელოვანი.
ნაბიჯი 3. იპოვეთ ხსნარის ტემპერატურა
როგორც ზემოთ ვნახეთ კლაუსიუს კლაპეირონის განყოფილებაში, სითხის ტემპერატურა გავლენას მოახდენს მის ორთქლის წნევაზე. საერთოდ, რაც უფრო მაღალია ტემპერატურა, მით მეტია ორთქლის წნევა - ტემპერატურის მატებასთან ერთად, მეტი სითხე აორთქლდება და წარმოქმნის ორთქლს, რაც გაზრდის წნევას კონტეინერში.
ჩვენს მაგალითში, ვთქვათ, შაქრის სიროფის ტემპერატურა ამ დროს არის 298 კ (დაახლოებით 25 C).
ნაბიჯი 4. იპოვეთ გამხსნელის ორთქლის წნევა
ქიმიურ საცნობარო მასალებს, როგორც წესი, აქვთ ორთქლის წნევის მნიშვნელობა ხშირად გამოყენებული ნივთიერებებისა და ნაერთებისათვის, მაგრამ ეს წნევის მნიშვნელობები ჩვეულებრივ მოქმედებს მხოლოდ იმ შემთხვევაში, თუ ნივთიერებას აქვს ტემპერატურა 25 C/298 K ან მისი დუღილის წერტილი. თუ თქვენს ხსნარს აქვს ერთი ასეთი ტემპერატურა, შეგიძლიათ გამოიყენოთ საცნობარო მნიშვნელობა, მაგრამ თუ არა, თქვენ უნდა იპოვოთ ორთქლის წნევა ამ ტემპერატურაზე.
- Clausius -Clapeyron დაგეხმარებათ - გამოიყენეთ ორთქლის საცნობარო წნევა და 298 K (25 C) შესაბამისად P1 და T1.
- ჩვენს მაგალითში, ჩვენს ნარევს აქვს ტემპერატურა 25 C, ასე რომ ჩვენ შეგვიძლია მარტივად გამოვიყენოთ ჩვენი მარტივი საცნობარო ცხრილი. ჩვენ ვიცით, რომ 25 C ტემპერატურაზე წყალს აქვს ორთქლის წნევა 23.8 მმ HG

ნაბიჯი 5. იპოვეთ თქვენი გამხსნელის მოლის ნაწილი
ბოლო რაც ჩვენ უნდა გავაკეთოთ, სანამ ამის მოგვარებას შევძლებთ, არის ჩვენი გამხსნელის მოლის წილის პოვნა. მოლის წილის პოვნა ადვილია: უბრალოდ გადააკეთეთ თქვენი ნაერთები მოლზე, შემდეგ იპოვეთ თითოეული ნაერთის პროცენტული რაოდენობა ნივთიერების მოლების საერთო რაოდენობაში. სხვა სიტყვებით რომ ვთქვათ, თითოეული ნაერთის მოლური ნაწილი უდრის (ნაერთის მოლი)/(მოლის მთლიანი რაოდენობა ნივთიერებაში).
-
დავუშვათ შაქრის სიროფის გამოყენების ჩვენი რეცეპტი 1 ლიტრი (ლ) წყალი და 1 ლიტრი საქაროზა (შაქარი).
ამ შემთხვევაში, ჩვენ უნდა ვიპოვოთ თითოეული ნაერთის მოლის რაოდენობა. ამისათვის ჩვენ ვიპოვით თითოეული ნაერთის მასას, შემდეგ გამოვიყენებთ ნივთიერების მოლურ მასას, რომ ის მოლებად გადავიყვანოთ.
- მასა (1 ლ წყალი): 1000 გრამი (გ)
- მასა (1 ლ ნედლი შაქარი): დაახლოებით 1,056, 8 გ
- მოლები (წყალი): 1000 გრამი × 1 მოლი/18.015 გ = 55.51 მოლი
- მოლები (საქაროზა): 1,056, 7 გრამი × 1 მოლი/342,2965 გ = 3,08 მოლი (გაითვალისწინეთ, რომ საქაროზის მოლური მასა შეგიძლიათ იპოვოთ მისი ქიმიური ფორმულისგან, C12თ22ო11.)
- სულ moles: 55.51 + 3.08 = 58.59 მოლი
- წყლის მოლური ნაწილი: 55, 51/58, 59 = 0, 947
ნაბიჯი 6. დასრულება
დაბოლოს, ჩვენ გვაქვს ყველაფერი რაც გვჭირდება რაულტის კანონის განტოლების გადასაჭრელად. ეს ნაწილი ძალიან ადვილია: უბრალოდ ჩაწერეთ თქვენი მნიშვნელობები ცვლადებისთვის გამარტივებული რაულტის კანონის განტოლებაში ამ განყოფილების დასაწყისში (პგამხსნელი = პგამხსნელიXგამხსნელი).
- ჩვენი ღირებულებების შეყვანისას ვიღებთ:
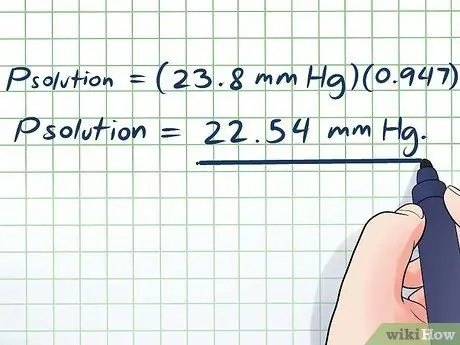
- პგადაწყვეტა = (23.8 მმ Hg) (0, 947)
-
პგადაწყვეტა = 22.54 მმ Hg.
შედეგი აზრიანია - მოლური თვალსაზრისით, ძალიან ცოტა შაქარია გახსნილი ბევრ წყალში (თუმცა რეალურ სამყაროში, ორივე ინგრედიენტს აქვს ერთი და იგივე მოცულობა), ამიტომ ორთქლის წნევა მხოლოდ ოდნავ შემცირდება.
მეთოდი 3 -დან 3: ორთქლის წნევის პოვნა სპეციალურ შემთხვევებში

ნაბიჯი 1. იყავით ფრთხილად სტანდარტული ტემპერატურისა და წნევის პირობებთან
მეცნიერები ხშირად იყენებენ ტემპერატურისა და წნევის მნიშვნელობებს, როგორც ადვილად გამოსაყენებელ "სტანდარტს". ამ მნიშვნელობებს ეწოდება სტანდარტული ტემპერატურა და წნევა (ან STP). ორთქლის წნევის პრობლემები ხშირად ეხება STP პირობებს, ამიტომ მნიშვნელოვანია გვახსოვდეს ეს მნიშვნელობები. STP ღირებულებები განისაზღვრება შემდეგნაირად:
- ტემპერატურა: 273, 15 კ / 0 გრადუსი / 32 ფ
- წნევა: 760 მმ Hg / 1 ატ / 101, 325 კილოპასკალი

ნაბიჯი 2. გადააკეთეთ კლაუსიუს-კლაპეირონის განტოლება სხვა ცვლადების მოსაძებნად
პირველ ნაწილში ჩვენს მაგალითში ჩვენ დავინახეთ, რომ კლაუსიუს - კლაპეირონის განტოლება ძალიან სასარგებლოა სუფთა ნივთიერებების ორთქლის წნევის მოსაძებნად. თუმცა, ყველა კითხვა არ მოგთხოვთ მოძებნოთ P1 ან P2 - ბევრი მოგთხოვთ იპოვოთ ტემპერატურის მნიშვნელობა ან ზოგჯერ H მნიშვნელობაც.ორთქლირა საბედნიეროდ, ამ შემთხვევებში, სწორი პასუხის გაცემა არის უბრალოდ განტოლების გადაწყობა ისე, რომ ცვლადები, რომელთა გადაწყვეტაც გსურთ, გამოითქვას ტოლობის ნიშნის ერთ მხარეს.
- მაგალითად, ვთქვათ, ჩვენ გვაქვს უცნობი სითხე ორთქლის წნევით 25 torr 273 K- ზე და 150 torr 325 K- ზე და გვსურს ვიპოვოთ ამ სითხის აორთქლების ენთალპია (ΔHორთქლი). ჩვენ შეგვიძლია ასე მოვაგვაროთ:
- ln (P1/P2) = (ΔHორთქლი/რ) ((1/T2) - (1/T1))
- (ln (P1/P2))/((1/T2) - (1/T1)) = (ΔHორთქლი/რ)
- R × (ln (P1/P2))/((1/T2) - (1/T1)) = Hორთქლი ახლა ჩვენ ვდებთ ჩვენს ღირებულებებს:
- 8, 314 J/(K × Mol) (-1, 79)/(-0, 00059) = Hორთქლი
- 8, 314 J/(K × Mol) × 3,033, 90 = Hორთქლი = 25,223, 83 J/mol

ნაბიჯი 3. გამოითვალეთ ხსნარის ორთქლის წნევა, როდესაც ნივთიერება აწარმოებს ორთქლს
რაულტის კანონის ზემოთ მოცემულ მაგალითში, ჩვენი ხსნარი, შაქარი, არ ახდენს რაიმე ზეწოლას ნორმალურ ტემპერატურაზე (იფიქრეთ - ბოლოს როდის ნახეთ, რომ შაქრის თასი აორთქლდა თქვენს ზედა კარადაში?) თუმცა, როდესაც თქვენმა ხსნარმა გააკეთა აორთქლდება, ეს იმოქმედებს თქვენს ორთქლის წნევაზე. ჩვენ ამას ვიღებთ რაულტის კანონის განტოლების შეცვლილი ვერსიის გამოყენებით: პგადაწყვეტა = (პნაერთიXნაერთი) სიმბოლო სიგმა (Σ) ნიშნავს, რომ ჩვენ მხოლოდ უნდა შევაჯამოთ სხვადასხვა ნაერთის ორთქლის წნევას ჩვენი პასუხის მისაღებად.
- მაგალითად, ვთქვათ, რომ ჩვენ გვაქვს ხსნარი ორი ქიმიკატისგან: ბენზოლი და ტოლუოლი. ხსნარის საერთო მოცულობაა 12 მილილიტრი (მლ); 60 მლ ბენზოლი და 60 მლ ტოლუოლი. ხსნარის ტემპერატურაა 25 ° C და თითოეული ამ ქიმიური ნივთიერების ორთქლის წნევა 25 ° C- ზე არის 95.1 მმ Hg ბენზოლზე და 28.4 მმ Hg ტოლუოლზე. ამ მნიშვნელობებით, იპოვეთ ხსნარის ორთქლის წნევა. ჩვენ შეგვიძლია ამის გაკეთება შემდეგნაირად, ჩვენი ორი ქიმიკატისთვის სტანდარტული სიმკვრივის, მოლური მასისა და ორთქლის წნევის მნიშვნელობების გამოყენებით:
- მასა (ბენზოლი): 60 მლ = 0.060 ლ და ჯერ 876.50 კგ/1,000 ლ = 0.053 კგ = 53 გ
- მასა (ტოლუოლი): 0.060 ლ და ჯერ 866, 90 კგ/1,000 ლ = 0.052 კგ = 52 გ
- მოლი (ბენზოლი): 53 გ × 1 მოლი/78, 11 გ = 0.679 მოლი
- მოლები (ტოლუოლი): 52 გ × 1 მოლი/92, 14 გ = 0.564 მოლი
- სულ moles: 0.679 + 0.564 = 1.243
- მოლური ფრაქცია (ბენზოლი): 0.679/1, 243 = 0.546
- მოლის ფრაქცია (ტოლუოლი): 0.564/1, 243 = 0.454
- გამოსავალი: პგადაწყვეტა = პბენზოლიXბენზოლი + პტოლუოლიXტოლუოლი
- პგადაწყვეტა = (95.1 მმ Hg) (0, 546) + (28.4 მმ Hg) (0, 454)
- პგადაწყვეტა = 51.92 მმ Hg + 12.89 მმ Hg = 64, 81 მმ Hg
Რჩევები
- იმისათვის, რომ გამოვიყენოთ კლაუსიუს კლაპეირონის განტოლება ზემოთ, ტემპერატურა უნდა გავზომოთ კელვინში (დაწერილია როგორც K). თუ თქვენ გაქვთ ტემპერატურა ცელსიუსში, მაშინ უნდა გადააკეთოთ იგი შემდეგი ფორმულის გამოყენებით: თკ = 273 + ტგ
- ზემოთ მოყვანილი მეთოდები შეიძლება გამოყენებულ იქნას, რადგან ენერგია ზუსტად პროპორციულია გამოყენებული სითბოს რაოდენობასთან. სითხის ტემპერატურა ერთადერთი გარემო ფაქტორია, რომელიც გავლენას ახდენს ორთქლის წნევაზე.






